Comparison of the efficiency of diluents on the enumeration of molds contaminated in spices and spice products
DOI:
https://doi.org/10.60136/bas.v6.2017.203Keywords:
Spice, Spice products, Mold, Diluents, Neutralizing agent, Antifungal activityAbstract
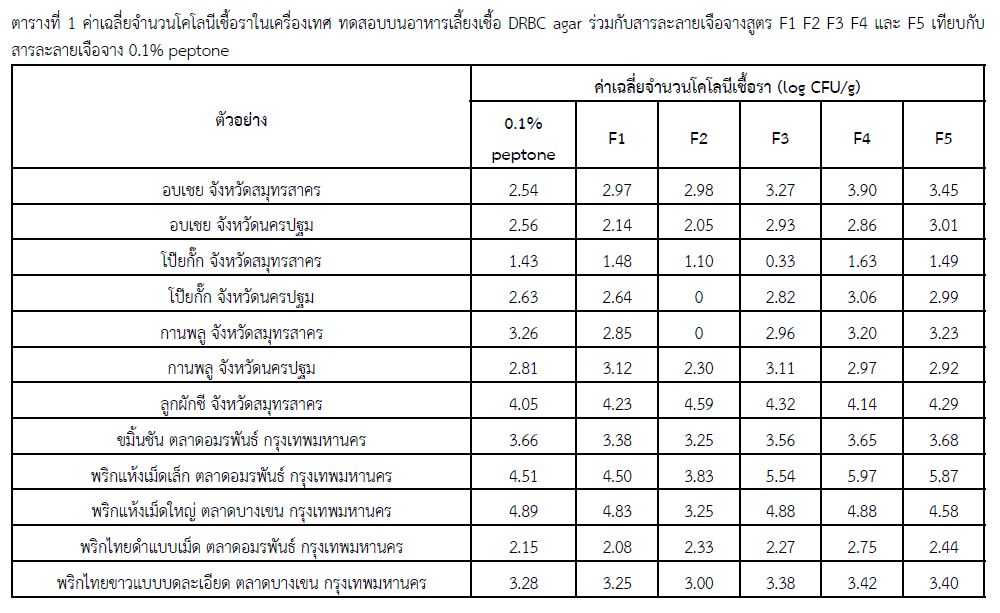
Fungal contamination of spices and spice products was critical problem for quality assurance of Thai food. Antifungal activity of spices caused underestimation on mold contamination. This study was aimed to improve the efficiency of enumeration of mold in spices and spice products. A total of 17 samples including 12 spices: dried chilli (2), pepper(2), clove (2), turmeric (1), Chinese star (2), coriander seeds (1), and cinnamon (2), and 5 spice products (green curry paste, mussaman curry paste, red curry paste, southern yellow curry paste, and Indian-style curry paste were subsequently examined on five diluents containing neutralizing agent : F1 (Bacteriological peptone 1 g/, Tween 80 30 m/1, L-00-Phosphatidylcholine : Lecithin 0.7 g/),F2(Bacteriological peptone 13/1, Tween 80 5 m/1, L-00-Phosphatidylcholine: Lecithin 7 g/1, Sodium thiosulfate 69/1, Sodium bisulfate 2.5 g/0), F3 (Fluid casein digest soya lecithin medium with polysorbate 20 40 mV/), F4 (L-Histidine 19/1, Tween 80 30 ml/l, L-O-Phosphatidylcholine 3 g/) and F5 (D/E Neutralizing broth (Himedia) The sample were cultured on plating culture media dichloran rose-bengal chloramphenicol agar (DRBC). The most effective diluents which inhibited antifungal properties of spices were F4 or F5, demonstrated by the average number of mold colonies of these formulas gave significantly higher than 0.1% peptone (control). In conclusion, the usage of F4 or F5 formulas as diluent incorporated with DRBC agar is an effective method for enumeration of mold in spices and spice products.
References
เอกรินทร์ ภัทรธนวดี, จิตศิริ ทองสอน, วราภา มหากาญจนกุล และ เพ็ญแข วันไชยธนวงศ์. ประสิทธิภาพสารต้านจุลินทรีย์ของสารสกัดเครื่องเทศต่อจุลินทรีย์ก่อโรคและจุลินทรีย์ที่ทำให้อาหารเน่าเสีย. เอกสารการประชุมทางวิชาการของมหาวิทยาลัยเกษตรศาสตร์ ครั้งที่ 44 : สาขาอุตสาหกรรมเกษตร สาขาเศรษฐศาสตร์ สาขาบริหารธุรกิจ, 2549, 297-307.
Beuchat L.R. and D. A. Golden. Antimicrobials occurring naturally in foods. Food Technology. 1989, 43, 134-142.
ฐิตินันท์ บัวบาน. ชนิดและจำนวนจุลินทรีย์ในเครื่องเทศและการเหลือรอดของจุลินทรีย์ในระหว่างการแปรรูปน้ำพริกตาแดงและการเก็บรักษา. วิทยานิพนธ์มหาบัณฑิต, มหาวิทยาลัยขอนแก่น 2552
ดวงจันทร์ สุขประเสริฐ และ วนิดา ยุรญาติ. สารพิษอะฟลาทอกซินที่ปนเปื้อนในเครื่องเทศ. วารสารสุขาภิบาลอาหาร, 2545, 4(2), 33-37.
อดิพล ดิลกพิม. ราและอะฟลาทอกซินในน้ำพริกแกงและเครื่องเทศที่เป็นองค์ประกอบ. วิทยานิพนธ์มหาบัณฑิต, จุฬาลงกรณ์มหาวิทยาลัย 2546.
USP. Microbiological Examination of Nonsterile Products: Microbial Enumeration Tests [online]. [viewed 11 February 2017]. Available from: https://hmc.usp.org/sites/default/files/documents/HMC/GCS-Pdfs/c61.pdf
JAYASHREE T. and C. SUBRAMANYAM. Antiaflatoxigenic activity of eugenol is due to inhibition of lipid peroxidation. Letters Applied Microbiology. 1999, 28, 179-183.
CRISTIANE B.S., S.S. GUTERRES, V. WEISHEIMER and E.S. ELFRIDES SCHAPOVAL. Antifungal activity of the lemongrass oil and citral against Candida spp. The Brazilian Journal of Infectious Diseases. 2008, 12(1), 63-66.
DARUGHE F., M. BARZEGAR and M. A. SAHARI. Antioxidant and antifungal activity of Coriander (Coriandrum sativum L.) essential oil in cake. International Food Research Journal. 2012, 19(3), 1253-1260.
BHATT MEHUL K, M.B. SHANJAR, K. SALUJA AJAY, D. KISHOR AND A.D. CAPTAIN. Evaluation of anti-microbial activity of Ocimum sanctum methanolic extract. Journal of Pharmaceutical and Scientific Innovation. 2012, 39-41.
SHIVA RANI S.K., NI SAXENA AND UDAYSREE. Antimicrobial activity of black pepper (Piper nigrum L.) Global Journal of Pharmacology. 2013, 7(1), 87-90.
TAJKARIMI, M.M., S.A. IBRAHIM AND D.O. CLIVER. Review antimicrobial herb and spice compounds in food. Food Control. 2010, 21, 1199-1218.
APISARIYAKUL A., N. VANITTANAKOM AND D. BUDDHASUKH. Antifungal activity of tumeric oil extracted from Curcuma longa (Zingiberaceae). Journal of Ethnopharmacol. 1995, 49, 163-169.
RATTANACHAIKUNSOPON P. AND PHUMKHACHORN P. Shallot (Allium ascalonicum L.) oil: diallyl sulfide content and antimicrobial activity against food-borne pathogenic bacteria. African Journal of Microbiology Research. 2009, 3, 747-750.
SEDEF N.E., N. KARAGOZLU, S. KARAKAYA AND S. SAHIN. Antioxidant and antimicrobial activities of essential oils extracted from Laurus nobilis L. leaves by using solvent-free microwave and hydrodistillation. Food and Nutrition Sciences. 2014, 5, 97-106.
KOCIĆ-TANACKOV S. D. AND G. R. DIMIĆ. Antifungal activity of essential oils in the control of food-borne fungi growth and mycotoxin biosynthesis in food. Microbial pathogens and strategies for combating them: science, technology and education. 2013, 838-849.
SCOTT V.W.S., W.P. DAVID, R. STEPHEN AND K.B. DANIEL. Validation of microbial recovery from disinfectants. Journal of Pharmaceutical Science and Technology. 2002, 56(5), 255-266.
INTERNATIONAL ORGANIZATION FOR STANDARDIZATION. ISO 21149: 2006. Cosmetics - Microbiology of Enumeration and detection of aerobic mesophilic bacteria.
INTERNATIONAL ORGANIZATION FOR STANDARDIZATION. ISO 16212: 2008. Cosmetics -- Microbiology - Enumeration of yeast and mould.
Downloads
Published
How to Cite
Issue
Section
License
Copyright (c) 2022 Bulletin of Applied Sciences

This work is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.









